Doenças de entressafra no milho
Ferrugem polissora, mancha de feosféria e complexo de helmintosporiose estão entre as doenças que atacam a cultura do milho e possuem grave incidência em regiões de plantio de segunda safra
Novo grupo químico a ser posicionado em aplicação foliar em soja, as carboxamidas representam importante aliado no combate a doenças que limitam a cultura. A utilização desses produtos, principalmente de modo preventivo e em mistura com estrobilurinas e triazóis, minimiza o risco de tolerância/resistência dos fungos, além de aumentar a eficácia e a vida útil desta ferramenta.
A inovação tecnológica especialmente no mercado de fungicidas tem proposto produtos cada vez mais seletivos, efetivos em doses menores, com modos e mecanismos distintos de ação, mais ágeis, com alto potencial protetor, formulações resistentes à ação de chuvas, menos tóxicos ao homem e ao ambiente e com menor risco de selecionarem raças resistentes.
O processo de descoberta de um novo ingrediente ativo demanda tempo e investimento, uma vez que o lançamento de uma nova molécula necessita no mínimo dez anos entre sua síntese, desenvolvimento do processo, produção, formulação, melhoramento, testes laboratoriais, pesquisa de campo para posicionamento e registro, métodos de aplicação, análises de resíduos e toxicidade. Para isso, o investimento é alto, sem contar que são analisadas mais de 140 mil substâncias por ano para se chegar a uma molécula comercial. É o caso do grupo químico das carboxamidas, que objetiva atender a todos os requisitos anteriormente descritos.
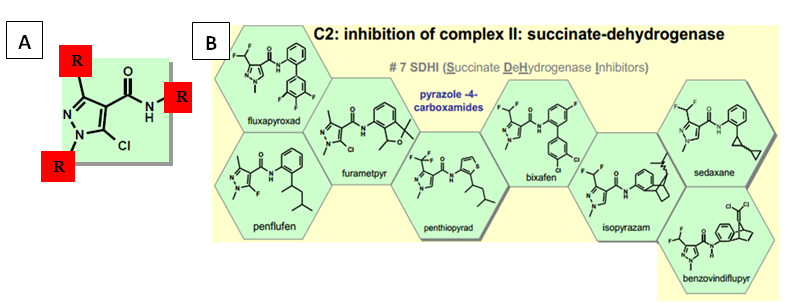
Como grupo químico carboxamida não é novo e seu primeiro ingrediente ativo foi descoberto em 1966 (carboxina). Há alguns anos, este grupo possui fungicidas posicionados para algumas culturas, como a carboxina em tratamento de semente e boscalida (2003) em HF. Em grandes culturas como a soja, não existia nenhum representante recomendado pelo Ministério da Agricultura, Pecuária e Abastecimento (Mapa) para aplicação foliar. Deste modo, o trabalho das empresas em buscar novos ingredientes ativos chegou ao desenvolvimento dos pyrazoles-4-carboxamidas (a partir de 2010), subgrupo das carboxamidas. Seus representantes possuem o mesmo arranjo molecular que os caracterizam, com variações nos radicais formando os ingredientes ativos diferentes (Figura 1 A e B). Assim, representam um novo grupo químico a ser posicionado em aplicação foliar para cultura da soja.
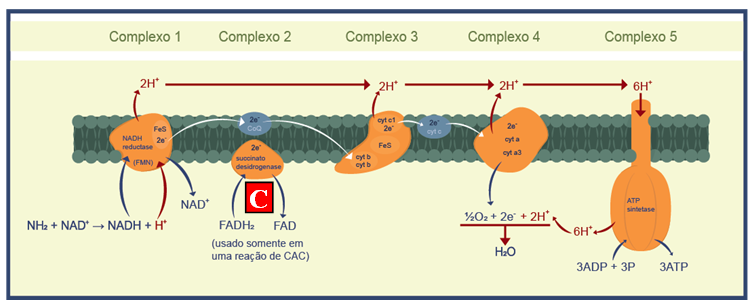
Na mitocôndria do patógeno, a respiração promove o fluxo de elétrons entre os complexos proteicos, que é fundamental para o movimento da ATP sintase, promovendo a ligação de um terceiro grupo fosfato aos dois fosfatos da adenosina (Figura 1). O produto desta ligação é o ATP (Adenosina TriPhosphato), encontrado universalmente nos sistemas vivos e tem como função essencial armazenar energia para as atividades vitais básicas das células. O ATP libera uma grande quantidade de energia utilizável quando é desdobrado pela adição de uma molécula de água (hidrólise).
Os ingredientes ativos do grupo das carboxamidas, assim como as estrobilurinas, atuam interrompendo este processo em complexos proteicos diferentes, privando o patógeno do principal produto, o ATP. Tecnicamente, o mecanismo de ação das carboxamidas apresenta efeito inibidor sobre a produção da enzima Succinato Desidrogenase (SDHI), atuante no Complexo II da cadeia de transporte de elétrons na mitocôndria do fungo, impedindo a oxidação de Succinato para Fumarato (Figura 2).
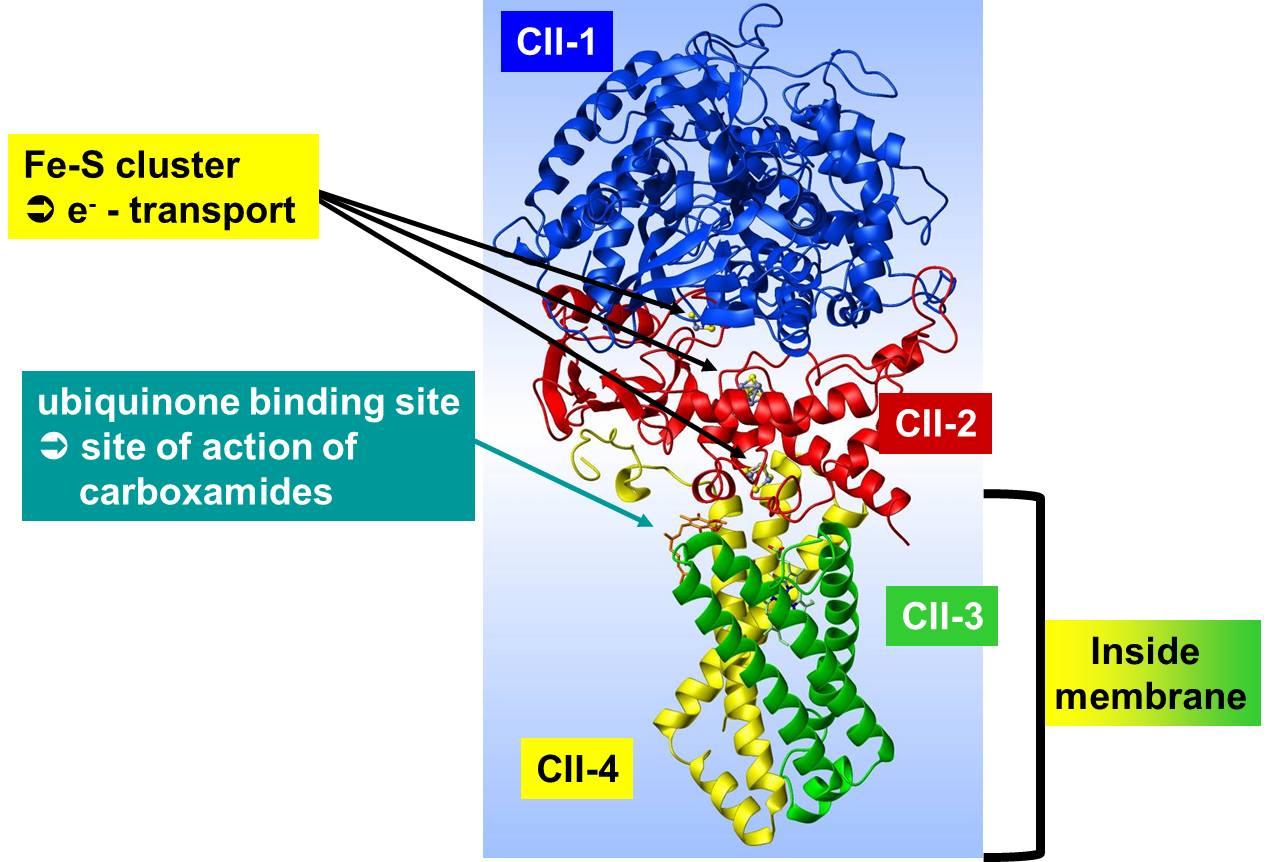
A estrutura da Succinato Desidrogenase (SDHI) é formada por quatro proteínas, CII-1 (flavoproteina) e CII-2 (proteína enxofre ferroso) e as proteínas CII-3 eCII-4 que são formadoras de polipeptídeos ligados às membranas (Figura 3). A proteína CII-2 é responsável pelo transporte de elétrons da cadeia respiratória do Complexo I para o Complexo III. Já a proteína CII-3 é o principal local de ação das carboxamidas, na ubiquinona da enzima. Assim, qualquer surgimento de resistência aos SDHI depende de um novo arranjo dos aminoácidos dentro da proteína.
Em âmbito celular, estudos do mecanismo de ação das carboxamidas ainda indicam seu efeito na biossíntese de proteínas, lipídeos, DNA e RNA, além de ser observada maior transformação de glicose ou acetato em succinato e uma diminuição na transformação de citrato, malato e fumarato.
O espectro de ação sobre os patógenos é normalmente variável. Alguns fungicidas pertencentes ao subgrupo dos pyrazoles apresentam boa ação em deuteromicetos, ascomicetos e basidiomicetos (ferrugens), já outros ficam restritos a estes últimos. Além disso, podem ter sua eficácia potencializada a partir da adição de ativos dos grupos químicos estrobilurinas e triazóis, conferindo maior espectro de controle, acrescentando consistência ao residual e reduzindo o risco de tolerância/resistência. Além disso, a ação dos ativos deste grupo sobre a fisiologia das plantas é notória e em maior magnitude que o apresentado pelo grupo das estrobilurinas, quando posicionados preventivamente, permitindo assim a absorção pelo tecido foliar.
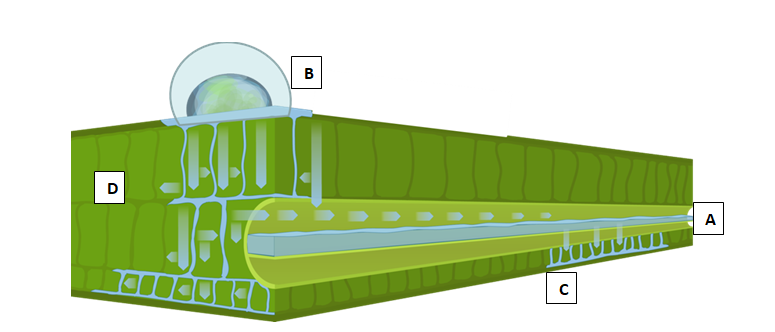
A lifofilicidade que alguns ativos deste grupo apresentam define-os como produtos de elevada mobilidade. Após a deposição dos fungicidas sobre os tecidos da planta, podem ser mobilizados através de transporte acropetal (xilema), episistêmico (adsorção na camada cerosa e redistribuição na fase vapor – grande quantidade do ativo mantém-se nestes tecidos), de forma translaminar, acumulando-se na face oposta da folha e mesostêmico (episistêmico e translaminar) (Figura 4). Existem diferenças entre ativos deste grupo químico quanto à lifofilicidade, mas alguns podem apresentar os quatro padrões de mobilidade.
Além de atuar nos esporos, micélio primário e secundário, uma redução na taxa de progresso da doença é observada de forma significativa. Contudo, embora pudesse ser atribuído efeito curativo eficaz, dados de campo demonstram uma ação fortemente preventiva – fato suportado tecnicamente, pois a fase de maior demanda de energia (ATP) pelo patógeno está no momento pré-infecção. Em ensaios conduzidos com aplicações curativas ou ainda erradicativas ficou evidente uma perda significativa de residual (Figura 5).
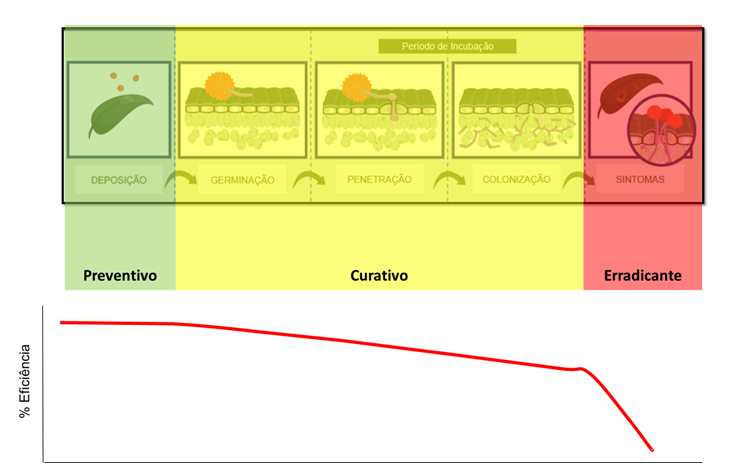
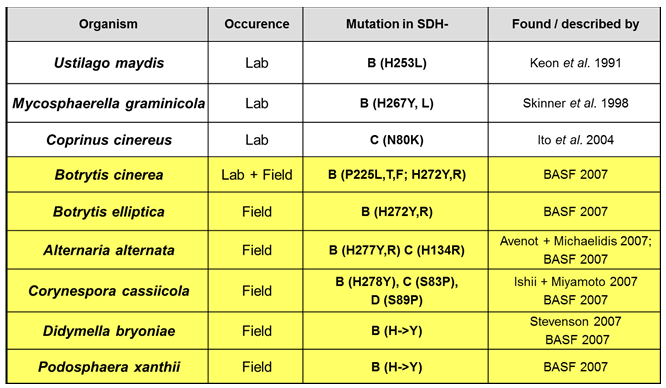
Todos os representantes do grupo das carboxamidas atuam sobre o mesmo sítio de ação mencionado anteriormente. Assim, o posicionamento tardio de qualquer ingrediente ativo do grupo poderá exercer uma pressão de seleção sobre a população do patógeno, acelerando o processo de queda de sensibilidade a todos os outros ingredientes ativos do mesmo grupo, caracterizando risco médio a alto de resistência cruzada (Frac, 2014). Portanto, o uso tardio de um produto pode vir a comprometer todo funcionamento deste novo grupo para manejo na cultura da soja (Figura 6).
A utilização de produtos com ingredientes ativos do grupo das carboxamidas, principalmente quando posicionados preventivamente e em mistura com estrobilurinas e triazóis, minimiza o risco de tolerância/resistência dos fungos a estes grupos químicos, aumenta a eficácia e a vida útil desta ferramenta.
Marcelo G. Madalosso, Instituto Phytus/Univ. Reg. Integr. - Santiago; Ricardo Balardin, Universidade Federal de Santa Maria
Artigo publicado em dezembro de 2014, na edição 187 da Cultivar Grandes Culturas.

Receba por e-mail as últimas notícias sobre agricultura